I. Consideratii teoretice
Atomul este format dintr-un nucleu central in jurul caruia orbiteaza electronii. Aceștia ocupa nivelele energetice din atom conform principiului lui Pauli. Starea fundamentala a atomului este cea cu energie minima a aranjamentului electronic. Starea excitata se obtine cand furnizam electronilor energie din exterior printr-un proces oarecare (termic, electromagnetic, etc.) și aceștia trec pe nivele superioare de energie ce corespund orbitelor mai indepartate de nucleu. Starea excitata este instabila, electronul se intoarce pe vechiul nivel de energie emitand un tren de unde electromagnetice, un foton, a carui frecventa n este legata de energia W prin relatia lui Planck:
W=h·n (1)
Energia fotonului emis este data de diferenta de energie dintre nivelul energetic superior al electronului in atom și cel inferior:
W=Wn Wm (2)
Fiecarei frecvente ii corespunde o linie spectrala situata fie in domeniu vizibil (3800 7600?), fie in cel invizibil (infrarosu, IR, sau ultraviolet UV). Totalitatea liniilor spectrale emise de o substanta formeaza spectrul de emisie. Fiecare atom are o configuratie electronica specifica (diferentele de enrgie intre nivelele electronice sunt diferite de la un atom la altul) și va avea un anumit spectru. Liniile spectrului ocupa pozitii stabile, de aceea putem identifica tipul atomilor ce le emit. Substantele aduse in stare atomica (prin incalzire la o temperatura mult mai inalta decat punctul de fierbere) dau spectre de linii. Acestea sunt caracteristice fiecarui element chimic și stau la baza unei metode de analiza chimica calitativa și cantitativa numita analiza spectrala.
In aceasta lucrare se va etalona scala unui spectroscop și se vor determina lungimile de unda ale radiatiilor emise de gazul dintr-un tub de descarcare.
II. Metoda experimentala
Dispozitivul experimental utilizeaza un spectroscop format dintr-un colimator C cu fanta F pe unde intra fascicolul luminos care este dirijat prin obiectivul Ob catre prisma P care descompune lumina dupa lungimea ei de unda. Spectrul rezultat este vizat prin ocularul Oc.
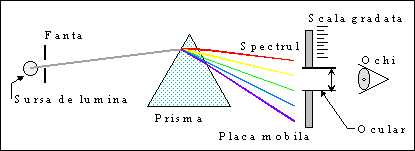
Modul de lucru
| Culoare | l (A=1010 m) |
| Roșu | 6234 |
| Galben 1 și 2 | 5790,7 și 5769,6 |
| Verde 1 și 2 | 5460,7 și 4958,7 |
| Albastru | 4916 |
| Indigo | 4358 |
| Violet1 | 4077 |
| Violet2 | 4046 |
Tabelul 2. Spectrul neonului (Ne)
| Culoare | Stralucire | l (A=1010 m) |
| Roșu aprins | 10 | 6402 |
| Roșu portocaliu satnga | 10 | 6143 |
| Portocaliu stanga | 5 | 5945 |
| Galben | 20 | 5852 |
| Verde (dupa galben) | 4 | 5760 |
| Verde (dublet stanga) | 8 | 5400 |
| Verde (dublet dreapta) | 6 | 5330 |
| Verde (dreapta din 5) | 5 | 5031 |
| Albastru-verde | 8 | 4849 |
Tabel de date pentru substanta etalon (Spectrul etalon)
| Culoarea liniei | |||||
| Diviziunea | |||||
| l (?=1010 m) | |||||
| n (1015 Hz) | |||||
| W=h·n (eV) |
Tabel de date pentru substanta necunoscuta
| Culoarea liniei | |||||
| Diviziunea | |||||
| l (A=1010 m) | |||||
| n (1015 Hz) | |||||
| W=h·n (eV) |
Tabel de date pentru culorile spectrului luminii albe
| Culoare | lMAX (A) | lMIN (A) | WMIN (eV) | WMAX (eV) |
| Roșu | ||||
| Oranj | ||||
| Galben | ||||
| Verde | ||||
| Albastru | ||||
| Indigo | ||||
| Violet |
Linii spectrale specifice altor substante
Na 5889,97 A si 5895,93 A (galben)
Cd 6438,5 A (rosu), 5085,8 A (verde) și 4799,9 (albastru)
Cu 5105,5 A, 5153,3A, 5218,2 A (verde), 5782 A (galben)