• Cuprins
• Introducere
• Capitolul 1
• Capitolul 2
• Capitolul 3
• Capitolul 4
• Capitolul 5
• Capitolul 6
• Capitolul 7
• Bibliografie
| |
|
|
 |
|
|
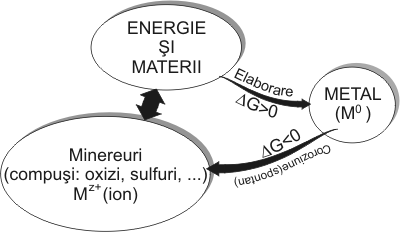
1.3. Coroziunea otelurilorMajoritatea cercetatorilor [75, 216, 80, 254, 230, 81, 222, 163, 82, 229, 2] definesc coroziunea ca fiind: distrugerea materialelor în general si a metalelor si aliajelor în special, sub actiunea mediului. Distrugerea poate fi partiala, totala sau poate antrena modificarea proprietatilor materialelor facându-le sa devina improprii pentru utilizare. Coroziunea este interpretata uneori impropriu ca uzura unei piese sau ca distrugerea unei structuri. 1.3.1. Aspecte generale ale coroziuniiDatorita structurii lor electronice, caracterizata prin prezenta electronilor asa-zisi “liberi” înreteaua cristalina, metalele si aliajele reactioneaza usor cu medii foarte diverse, corodându-se (oxidându-se). Rezulta ca adevarata cauza a coroziunii metalelor si aliajelor este instabilitatealor termodinamica în conditii naturale si deci tendinta lor spontana de a trece în stare oxidata (în combinatii) [80, 254, 230, 81, 222, 163]. Asa se explica faptul ca în natura majoritatea metalelor, cu exceptia metalelor nobile (Au, Pt, Ir), se gasesc în stare combinata (oxidata - minereuri), fenomen pe care l-am ilustrat în figura 1.3.1.
Energetic, tendita metalelor de a se coroda, este caracterizata de variatia entalpiei libere Ga procesului, care însa nu evidentiaza obstacolele ce stau în calea reactiei si viteza ei [229]. Fenomenele de coroziune a materialelor (metalelor) se manifesta doar prin contactul materialului cu mediul si în acest sens am reprezentat schematic un sistem de cororziune în figura 1.3.2.
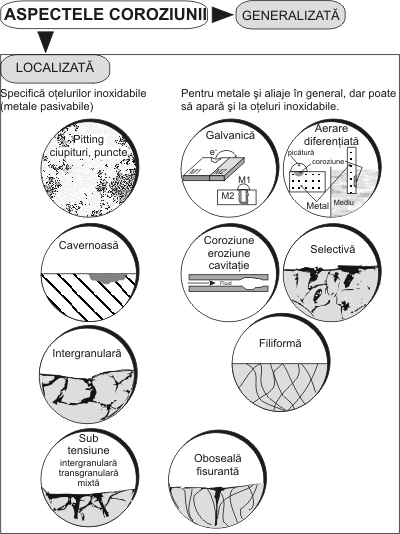
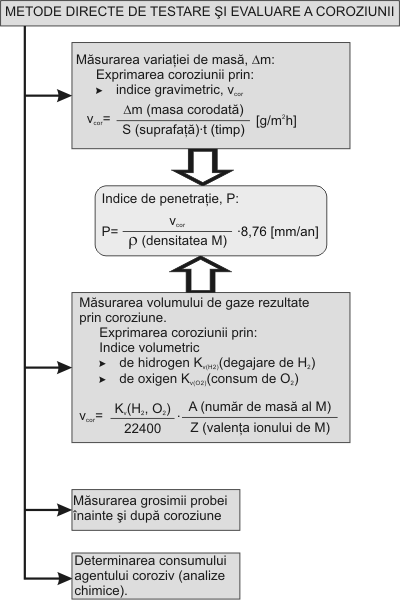
Aspectele economice privind coroziunea, la nivel de pierderi directe, cât si indirecte, fara a uita munca si mijloacele financiare risipite pentru masurarea lor sunt de o importanta deosebita. Pe baza datelor din literatura [82, 2, 1] am prezentat, în figura 1.3.3 aspectele economice privind coroziunea, la nivel de pierderi directe, cât si indirecte. Aprecierea coroziunii dupa aspect, felul si aria de rapândire pe suprafata sau în interiorul materialului, s-a ilustrat în figura 1.3.4.
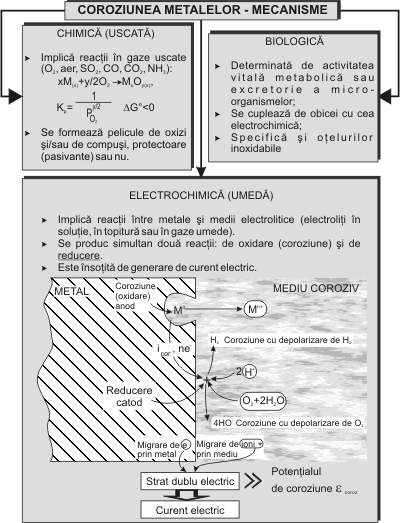
Este cunoscut faptul ca fenomenele de coroziune se desfasoara dupa mecanisme diferite în functie de natura mediului coroziv ca în figura 1.3.5. În teza, am urmarit în special coroziunea electrochimica a otelurilor inoxidabile, înainte si dupa aplicarea unor tehnologii de ingineria suprafetelor.
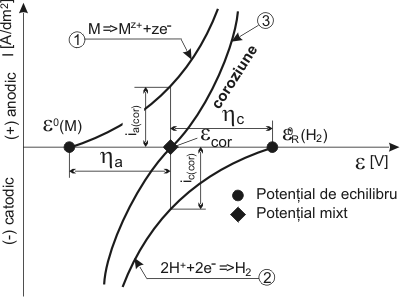
Sistemul electrochimic de coroziune, metal (aliaj) - mediu coroziv, duce la formarea unui strat dublu electric, asimilat cu un condensator, unde se stabileste o diferenta de potential între suprafata metalului care s-a încarcat negativ (ne‾) si cea a mediului care devine pozitiva (datorita ionilor de M+ rezultati din coroziune). Aceasta diferenta de potential este potentialul unic la care se produce coroziunea si se numeste potential de coroziune ecoroz sau potential mixt. Potentialul de coroziune ecoroz al unui metal sau aliaj difera de potentialul de echilibru eM0 al metalului sau aliajului [229, 213, 19,180, 26], figura 1.3.6 [75].
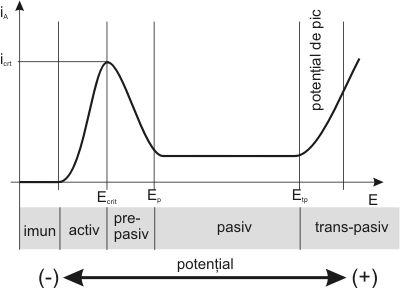
Coroziunea implica doua reactii simultane (figura 1.3.5) cu schimb de ioni si electroni între metal si mediu si ca urmare a acestui schimb în timpul coroziunii pe metal (aliaj) apare potentialul ecoroz, a carui valoare se stabileste prin deplasarea unuia spre celalalt a potentialelor de echilibru a metalului eM0 si mediului eD0 (D este depolarizantul din mediu). Deplasarea celor doua potentiale de echilibru, la potentialul de coroziune este o consecinta a fenomenelor de polarizare anodica (ηa si catodica (ηc) a proceselor de electrod, fenomen ce apare instantaneu la contactul metal - mediu. Viteza de coroziune se poate afla din curentul de coroziune icoroz ce apare în timpul procesului. În procesele de oxidare anodica (coroziune), la unele metale apare uneori la o anumita valoare a polarizarii o rezistenta brusca la dizolvare (coroziune), ceea ce conduce la o scadere a curentului de coroziune pâna la valori foarte apropiate de zero, ca urmare a pasivarii metalului [101, 106, 108, 27]. Prevederea comportarii la coroziune umeda (electrochimica) a unui material, se poate face analizând curba de polarizare anodica (sau depasivare) a metalului respectiv, care permite separarea potentialelor electrochimice a aliajului în domeniile de imunitate, activitate, pasivitate, transpasivitate (figura 1.3.7).
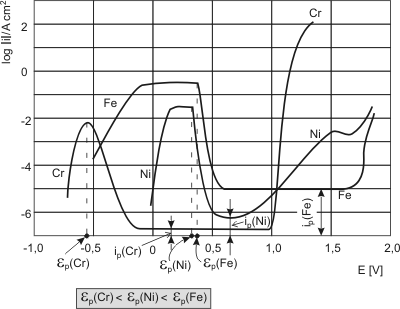
1.3.2. Coroziuneaotelurilor inoxidabileÎn cazul otelurilor inoxidabile în special si a materialelor pasivabile în general, polarizatia este deplasarea potentialului de echilibru sub actiunea trecerii curentului electric propriu de coroziune, produs de cele doua reactii chimice simultane care produc coroziunea. În cazul aliajelor Fe-Cr, în care cromul formeaza cu Fe, solutii solide,cromul are tendinta foarte pronuntata de pasivare si joaca rolul componentului protector [90, 100,131, 115, 251]. Daca vom compara curbele de polarizare anodica a fierului, cromului si nichelului (componente principale în otelurile inoxidabile) figura1.3.8, cu cele ale aliajelor FeCr se poate constata ca potentialele de pasivare a aliajelor Fe-Cr sunt apropiate de cele ale cromului pur si se situeaza între cel al fierului si cromului pur.
Componentii aliajelor au afinitati diferite fata de agentii corozivi si în acelasi timp si viteze de difuzie diferite prin oxid sau fazele aliajului ceea ce face ca oxizii rezultati pe suprafata sa nu contina aceleasi cantitati relative ale componentilor din aliaj [135, 216, 215, 229, 248, 165, 15, 46, 192, 141]. În prezent se cunoaste ca rezistenta ridicata la coroziune a otelurilor inoxidabile este data de pelicula (filmul) pasiva formata la suprafata otelului. Compozitia si modul de formare a acestui film constituie înca subiecte de cercetare. Lucrarile lui M.B.PILLING si R.BEDWORTH [173], WAGNER, SCHOTTKY-HAUFFE [244, 245, 246] si alte cercetari mult mai recente, au adus contributii importante la elucidarea rolului elementelor de aliere, la cinetica si mecanismul formarii stratului pasiv. Dupa acesti autori, oxigenul se dizolva în fier (elementul majoritar) si formeaza cei trei oxizi ceea ce duce la oxidarea interna a aliajului. Oxidarea preferentiala a fierului, face ca interfata metal/oxid sa se îmbogateasca în elementul de aliere (Cr). Oxizii primari rezultati sufera o serie de transformari la limita metal/oxid. Astfel FeO se combina cu Cr2O3 si formeaza FeCr2O4 (FeO,Cr2O3) rezultând un strat interior alcatuit din doua faze. În perioada de crestere a peliculei de oxid, FeO trece în Fe3O4 care se combina cu FeCr2O4 si formeaza un amestec spinel mixt (Fe2+,Fe 3+, Cr 3+)2O 4 . La interfata oxid/mediu oxidant, fierul trece în Fe 2 O 3 si se formeaza oxid spinelde tip (Fe 3+ ,Cr 3+ ) 2 O 3 . Oxizii spinel, au o structura compacta si formeaza pe otel straturi (pelicule) superficiale, prin care viteza de difuzie este mult mai mica decât prin straturile de oxizi simpli si ca urmare aceste pelicule de oxizi spinel vor proteja metalul împotriva coroziunii - metalul devine pasiv, fig.1.3.9 [163, 82,34, 5, 217].
Actiunea protectoare a cromului (formarea filmului pasiv), nu se manifesta la valori continue ale concentratiei, ci apare la atingerea anumitor continuturi în elemente de aliere, corespunzatoare unor fractii atomice n/8 (n=1,2,3,4,5,6,7) sau în % de masa (11,8; 23,7; 35,8) [15, 84, 127]. Contributia cromului la pasivarea otelului se poate explica si prin teoria electronica. Cromul având afinitate mare pentru electroni poate adsorbi electroni 3d de la fier. Astfel fierul devine pasiv, prin pierderea unui electron 3d, pe care-l transfera în substratul 3d al cromului. Cromul poate prelua 5 electroni, adica poate pasiva 5 atomi de Fe. Aceasta proportie corespunde la 15,7% Cr în greutate, fapt care explica de ce continutul de peste 12% Cr, confera otelului o buna rezistenta la coroziune. Fenomenul este confirmat si de lucrarile [163, 127, 130, 252]. Natura filmului pasiv în medii umede, a preocupat pe multi cercetatori, a constituit si mai constituie înca obiect de disputa între specialisti. O serie de cercetatori [82, 248, 165, 88], stabilesc ca în solutii apoase, stratul pasiv este fie un oxid cristalizat, fie o compozitie apropiata de o structura amorfa care include si atomi ai metalului de baza, atomi de oxigen, hidrogen sau molecule de apa, constituind de fapt un amestec de oxizi si hidroxizi de fier si crom cu legaturi sub forma de punti între acesti compusi. Frânarea difuziei speciilor ionice prin filmul pasiv este interpretata de H. STREHBLOW [206] ca si cum filmul pasiv ar fi o rezistenta cu o capacitate, o impedanta sau un semiconductor. Diferenta de potential între cele doua interfete metal-film si film-mediu arata ca filmul pasiv este sediul unui puternic câmp electric si poate fi studiat ca atare. La otelurile inoxidabile, prin pasivare, pozitivarea potentialului de interfata metal-mediu este de 0,55 V [105, 13]. Filmul pasiv este foarte aderent si cu o grosime de ordinul a câtorva zeci de Angstrom, dar cu o foarte scazuta permeabilitate ionica, ceea ce face ca transferul de cationi din metal spre mediu (coroziunea) sa fie foarte scazut, practic neglijabil [38]. Viteza de coroziune, este data de reactia de dizolvare a metalului care produce cationi metalici ce trec în mediu si în acelasi timp electroni care circula prin metal producând curent electric, care este chiar curentul de coroziune i cor . (vezi figura 1.3.8). În domeniul pasiv curentul ce traverseaza interfata metal/film/solutie (curentul de pasivare)corespunde unei valori minime, dar nu este nul, deci coroziunea este foarte mult încetinita. Problema practica nu este de a determina curentul de “coroziune” la pasivare, ci conditiile de formare si de “stabilitate” a filmului protector [219, 98, 101]. Lucrari recente sugereaza ca filmul pasiv nu este o stare “stabila”, dar este o stare “stationara”; el este în echilibru cu mediul, dar în permanenta distrugere si refacere [27]. Stabilitatea precara a filmului pasiv face ca el sa fie susceptibil la actiunea a o serie de agenti exteriori (fizici, chimici, termici sau mecanici) care-l distrug local provocând astfel atacuri pernicioase localizate importante [137]. Din acest motiv otelurile inoxidabile sunt sensibile la coroziune (atac) localizat, datorate în toate cazurile defectelor sau rupturilor punctuale ale stratului pasiv. Cauzele ruperii filmului pasiv pot proveni din: particularitatile de structura a metalului (marginea grauntilor, incluziuni etc.), din efecte geometrice de suprafata sau efecte mecanice [200, 128, 62]. Ruperea filmului pasiv este legata si de procesele de deformare plastica, în masura sa provoace deplasarea spre suprafata a dislocatiilor care sunt activate de o anumita tensiune, formând aparent o noua suprafata activa si nepasivata. Daca filmul pasiv nu are suficienta plasticitate sa se adapteze la noua geometrie, se rupe si ca urmare se declanseaza coroziunea. Pe de alta parte OLTRA, LEMAITRE, [162] arata ca o elasticitate buna a filmului pasiv, poate conferi aliajului o însemnata rezistenta la coroziune sub tensiune si deformare plastica. Chiar daca are loc o rupere locala momentana a filmului pasiv acesta se reface rapid fara a avea timp sa se declanseze si sa se dezvolte coroziunea localizata. Dupa AHUKA-SHAMBA si ROQUES [16] un film pasiv format într-un mediu nu îsi pastreaza totdeauna proprietatile protectoare la schimbarea mediului, deoarece în fiecare sistem metal-mediu creat, intervin procese chimice si/sau fizice specifice interfetelor, fig.1.3.10 [137, 184].
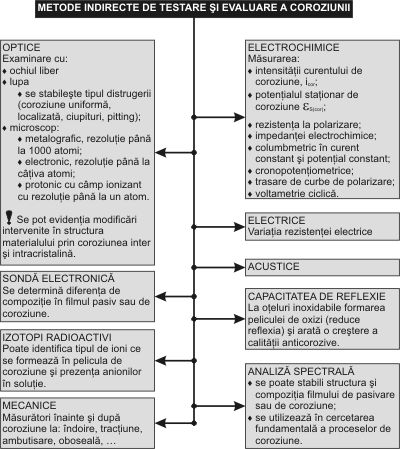
Coroziunea localizata (în puncte, intergranulara, etc) este specifica otelurilor inoxidabile asa cum s-a aratat în fig.1.3.4. Acest tip de coroziune este totdeuna foarte rapida motiv pentru care este numita si coroziune “catastrofala”, însotita adesea si de un cuplaj galvanic între partea corodata a suprafetei si cea protejata. Otelurile inoxidabile sunt susceptibile la coroziunea în puncte în special în solutii ce contin ionide Cl -, Br -, dar nu apare de obicei în solutii de ioni deSO 4 2- sau NO 3 - . Coroziunea în puncte este caracterizata de potentialul de pic , care este cel mai negativ potential la care se initiaza si se propaga unul sau mai multe puncte de coroziune sau este definit ca cel mai pozitiv potential care are ca rezultat scaderea curentului datorat pasivariiîntregii suprafete. El nu este un parametru fix, depinde de metoda utilizata. Potentialul critic de pic este potentialul la care apare o crestere brusca a curentului de coroziune [37, 91, 253, 158,181, 201]. Coroziunea în puncte (ciupituri) este una din formele cele mai grave de coroziuni localizate,ea poate duce pâna la perforarea peretelui metalic al piesei fara a fi observata în exterior [41,175]. Metode de încercare la coroziune. Din analiza datelor bibliografice [81, 34, 256, 228, 127,67, 199, 168, 157, 118, 28] se poate spune ca încercarile la coroziune se refera fie la material, fiela sistemul de protectie aplicat. Realizarea lor se face în laboratoare, sau pe santier, asupraesantioanelor, machetelor sau chiar pe întreaga instalatie. Având în vedere diversitatea formelor de coroziune expuse, este periculos a se faceextrapolari între diverse categorii de metode de încercare la coroziune. Figurile 1.3.11 si 1.3.12 sintetizeaza metodele directe si indirecte de testare si evaluare acoroziunii. O serie de cercetatori [138, 49, 108, 147, 92, 155, 106, 170, 58, 255, 60] aratadificultatea deosebita a identificarii si aprecierii coroziunii în pitting, atât în cazul otelurilorinoxidabile cât si a sistemelor de protectie
|
||||||||||||||||||||||||||||||||||||||||
|
|